|
一.复习建议
1、参照近三年高考试题,把握复习方向
2、知识的扩展不脱离课本,教材内容的深挖不超纲
3、重视化学与社会的联系,注重解决实际问题
二.关注2005年高考试题特点
1、基本概念、基本理论知识与元素化合物、实验、计算知识融合,以学科内综合的形式进行命题
2、综合题目难、中、易搭配合理、由易到难梯度明显,得分容易,得高分难,具有较好的区分度。
三.考点分析
I卷05题主要考点 化学与社会 热化学方程式 元素周期律综合知识
氧化还原的概念 电化学知识
离子共存、离子方程式 官能团与有机物的性质 摩尔、阿伏加德罗定律
化学基本实验 溶液 化学平衡判断
考点1:,化学与社会紧密联系——学科知识与解决实际问题围绕能源、资源、环境、健康、社会可持续发展设问
复习建议:1、注意对问题进行多角度思考和解决
2、训练审题、筛选信息的能力
1、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂在470℃、80MPa 下合成出金刚石,具有深远意义。下列说法不正确的是
A、由二氧化碳合成金刚石是化学变化
B、金刚石是碳的一种同位素
C、钠被氧化最终生成碳酸钠
D、金刚石中只含有非极性共价键
2、高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是
A 臭氧和氧气是氧的同素异形体 B 臭氧可使湿润的KI淀粉试纸变蓝
C 臭氧的存在对人体有益无害 D 臭氧是很好的消毒剂和脱色剂
3、能与人体血液中血红蛋白结合的一种有毒气体是
A、氯气 B、氮气 C、一氧化碳 D、甲烷
4、现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤做燃料,③燃煤时鼓入足量空气、,④开发清洁能源。其中能减少酸雨产生的措施的是
A ①②③ B ②③④ C ①②④ D ①③④
5、2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是
A、“绿色化学”工艺,使原料尽可能转化为所需要的物质
B、大量开采地下水,以满足社会对水的需求
C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D、节约能源,提高能源利用率
6、自来水厂对天然水进行净化消毒,通常使用液氯,有些不法商贩用自来水冒充“纯净水”销售,能检验出这种假冒纯净水的试剂是
7、铜锌合金制成的假金元宝欺骗行人的事件屡有发生,下列不易区别其真伪的方法是
A、测定密度 B、放入硝酸中 C、放入盐酸中 D、观察外观
8、为了使鱼苗顺利运输,必须满足三个条件:(1)需要保持适量的氧;(2)使鱼苗呼吸排出的二氧化碳气及时排出;(3)防止细菌大量繁殖。已知下列四种物质加入水中都可起到供氧杀菌作用,在长距离运输鱼苗时,最好在水中加入
A.过氧化钠 B.氯水 C.过氧化钙 D.双氧水
考点2:离子方程式和离子共存判断
近年考点:燃烧热的概念和计算、中和热的测定和计算、正确书写热化学方程式、判断热化学方程式的正误、反应热大小比较
复习建议
归纳拆什么——强酸、强碱、可溶性盐
归纳离子间不共存的原因
与H+不共存的离子: OH-、 AlO2-、 ClO-、 CO32-等多种弱酸根,HCO3- 等酸式根
与OH-不共存的离子: H+ 、NH4+、HCO3-、 Fe2+、 Cu2+
ClO-、 NO3- 的氧化性;
注意附加条件:有色离子、pH条件等
判断正误的一般方法:电荷、原子守恒,反应物过量
1.能用离子方程式H++OH-=H2O表示的反应是
A 稀醋酸和稀氨水反应 B 稀硫酸和烧碱溶液反应
C 稀盐酸和氢氧化铜反应 D 稀硫酸和氢氧化钡溶液反应
2.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
3.下列离子方程式正确的是
A 碳酸氢钠溶液中加入盐酸:CO32-+2H+→CO2↑+H2O
#B 硫化亚铁与盐酸反应:S2¯+2H+→H2S↑
C 苯酚钠溶于醋酸溶液:C6H5O¯+CH3COOH→C6H5OH+CH3COO¯ D 氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl¯
4、下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+ === Ca2+ + 2H2O
B.钠与水的反应Na + 2H2O === Na+ + 2OH -+ H2↑
C.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + Ag
D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
5、下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水 Al3++30H-══Al(OH)3↓
B.电解饱和食盐水 2Cl-+2H2O H2↑+C12↑+20H-
C.碳酸钙与盐酸反应 CaCO3 + 2H +═ Ca2++ CO2↑ +H2O
D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
Fe2++2H++H2O2══Fe3++2H2O
考点3:反应热、热化学方程式的应用
近年考点:燃烧热的概念和计算、中和热的测定和计算、正确书写热化学方程式、判断热化学方程式的正误、反应热大小比较
复习建议:帮助学生自己总结——书写热化学方程式与普通化学方程式的区别
⊿H数值的计算、正或负号的含义、
为什么必须注明物质的状态、什么情况下出现分数系数
1、已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2bkJ/mol
B C2H2(g)+5/2O2(g)=2CO2(g)+ H2O(l);ΔH=2bkJ/mol
C 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4bkJ/mol
D 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=bkJ/mol
2、氢气(H2)一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别如下
H2(g)+ 1/2 O2(g)= H2O(l);⊿H = -285.8kJ/ mol
CO(g)+ 1/2 O2(g)= CO2(g);⊿H = -283.0kJ/ mol
C8H18(g)+ 25/2 O2(g)= 8CO2(g)+ 9 H2O(l);⊿H = -5518kJ/ mol
CH4(g)+ 2 O2(g) = CO2(g)+ 2 H2O(l);⊿H = -890.3kJ/ mol
相同质量的H2、、、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A、H2、(g)、 B、CO (g) C、C8H18 (l) D、CH4(g)
3、已知在101 kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2mol CH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6﹒30倍,CH4完全燃烧反应的热化学方程式是
考点4:元素周期律
复习建议:强调基本知识——1~20号元素的序数、结构、位置
主族元素的原子结构、原子半径、化合价、性质递变规律
周期表的结构、氢键
1、下列说法正确的是
A 常温常压下,只有一种元素的单质呈液态
B 周期表中所有元素都有从自然界中发现的
C 过渡元素不全是金属元素
D 常温常压下,气态单质的分子都是由非金属元素的原子形成的
2、右表为元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙中正确的是
A 常压下五种元素的单质中Z单质的沸点最高
B Y、Z的阴离子电子层结构都与R原子的相同
C W的氢化物沸点比X的氢化物的沸点高
D Y元素的非金属性比W元素的非金属性强
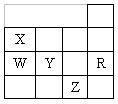
3、同一主族的两种元素的原子序数之差不可能是
A 16 B 26 C 36 D 46
4、.短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
A.X与Y不可能位于同一主族
B.X与Y一定位于同一周期
C.X与Y可能形成共价化合物XY
D.X与Y可能形成离子化合物XY
5、下列说法正确的是
A、H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B、在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C、HI的相对分子质量大于HF,所以HI的沸点高于HF
D、由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
6、下列分子中所有原子都满足最外层为8电子结构的是
A SiCl4 B H2O C BF3 D PCl5
考点5:电解质溶液
化学反应速率、化学平衡理论适用于弱电解质的电离、盐的水解
1、相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A 弱酸溶液产生较多的氢气 B 强酸溶液产生较多的氢气
C 两者产生等量的氢气 D 无法比较两者产生氢气的量
2.关于小苏打水溶液的表述正确的是
A.c(Na+) = c(HCO3—)+ c(CO32—)+ c(H2CO3)
B.c(Na+) + c(H+)= c(HCO3—)+ c(CO32—)+ c(OH—)
C.HCO3—的电离程度大于HCO3—的水解程度
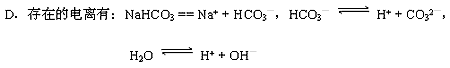
3、欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3¯)都减少,其方法是
A 通入二氧化碳气体 B 加入氢氧化钠固体
C 通入氯化氢气体 D 加入饱和石灰水溶液
4、已知0.lmol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等

6、关于电解NaCl水溶液,下列叙述正确的是
A 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C 电解时在阳极得到氯气,在阴极得到金属钠
D 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
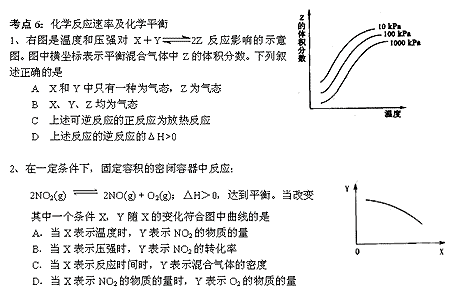

措施是
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大压强
考点7:氧化还原反应
复习建议: (1)氧化还原的相关概念、电子转移的方向和数量
(2)配平氧化还原方程式:注意有序进行
灵活处理:电荷守恒配平离子方程式
(3)氧化还原的简单计算:用得、失电子数相等关系
金属与酸、碱、水的反应,本质是失电子
1、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3 + H2C2O4 + H2SO4 = 2ClO2↑ + K2SO4 +2CO2↑+2H2O
下列说法正确的是
A、KClO3在反应中得到电子 B、ClO2是氧化产物
C、H2C2O4在反应中被氧化 D、1mol KClO3参加反应有2mol电子转移
2.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag ==Tl+ + 2Ag+。下列推断正确的是
|
